染色说明书
染色说明书

染色前准备
切片准备
载玻片要求
标准75.5±05 x 25.5±0.5 mm
大小载玻片,表面经过polylysine处理带有正电荷,
免疫组化专用载玻片。
 注意:如果使用全自动荧光病理扫描仪,不要用圆角载玻片。
注意:如果使用全自动荧光病理扫描仪,不要用圆角载玻片。
切片要求
厚度:3±1µm;
常规免疫组化烤片,如40°C过夜/75°C 15-30min/1h 60°C)
常规二甲苯脱蜡如2x10min
常规免疫组化中的系列酒精99%-95%-70%-H₂O洗涤。
常规免疫组化烤片,如40°C过夜/75°C 15-30min/1h 60°C)
常规二甲苯脱蜡如2x10min
常规免疫组化中的系列酒精99%-95%-70%-H₂O洗涤。
抗原修复
抗原修复(~1h)
常规使用您平时使用的抗原修复方法,例如,
1. 如果自动化:可以使用Leica Bond的抗原修复程序;
2. 如果手工:将切片插入一个半透明切片夹或切片缸中,缸内充满使用10 mM Tris-buffer 1mM EDTA pH 8-(sigma Tris-EDTA 100x浓缩液,T9285)的缓冲液。放置在家用微波炉中,设置为“高”或850W 8min(应在8min内剧烈沸腾),将功率降低到“低”或300W,并允许20-30min的间歇启动以保持沸腾。在转移到洗涤缓冲液(如TBS- Ts)之前,冷却至50°C或更低,以允许抗原重新折叠。
1. 如果自动化:可以使用Leica Bond的抗原修复程序;
2. 如果手工:将切片插入一个半透明切片夹或切片缸中,缸内充满使用10 mM Tris-buffer 1mM EDTA pH 8-(sigma Tris-EDTA 100x浓缩液,T9285)的缓冲液。放置在家用微波炉中,设置为“高”或850W 8min(应在8min内剧烈沸腾),将功率降低到“低”或300W,并允许20-30min的间歇启动以保持沸腾。在转移到洗涤缓冲液(如TBS- Ts)之前,冷却至50°C或更低,以允许抗原重新折叠。
 注意:小心烫伤。如果暂时停留在这一步,将切片储存在含50%甘油蔗糖TBS的保存液
。
注意:小心烫伤。如果暂时停留在这一步,将切片储存在含50%甘油蔗糖TBS的保存液
。
包被
包被(10min-1h)
常规使用您平时使用的包被方法,例如5% w/v
脱脂奶粉TBS-T溶液(或TBS-Ts溶液)10min——1h包被。
抗体准备
一抗和二抗染色准备(~5min)
制备一抗二抗工作液:泰立瑞mIF提供抗体稀释液进行一抗和二抗的稀释(使用平时您常规使用的一抗浓度,如果没有,尝试一抗稀释到1
µg/ml左右往往是一个好开始。泰立瑞提供的荧光标记二抗稀释到5µg/ml左右
(~1:200 – 1:300))。
 注意:针对低丰度靶标,一抗时尽量选择Rabbit一抗,多克隆Rabbit一抗更好,中高丰度靶标使用Mouse一抗。
注意:针对低丰度靶标,一抗时尽量选择Rabbit一抗,多克隆Rabbit一抗更好,中高丰度靶标使用Mouse一抗。
染色流程
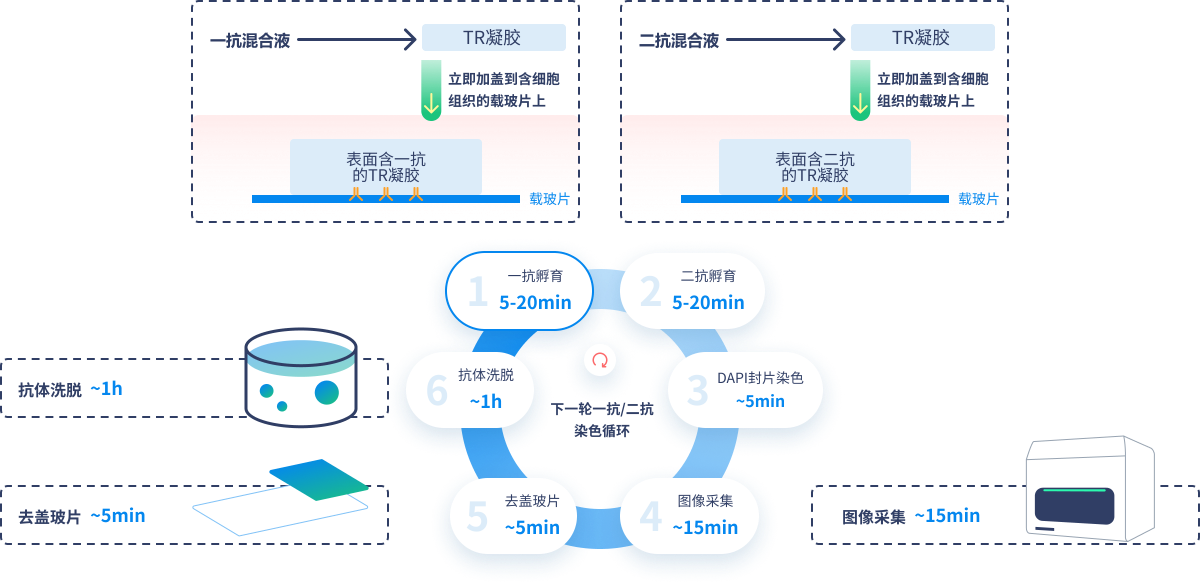
1
一抗孵育(5-20min):从试剂套装密封袋里取TR凝胶一块,加3µl(细胞片)或20µl(组织切片)的一抗混合液(靶点1+靶点2)加在TR凝胶表面,然后立即将表面含一抗的TR凝胶加盖到含有细胞/组织的载玻片上,室温或37°C孵育,5min(细胞片)或20min(组织切片)。无需洗涤,快速进行二抗孵育,避免样本表面干枯。
2
二抗孵育(5-20min):一抗孵育结束时,取一块新TR凝胶加3µl(细胞片)或20µl(组织切片)的二抗混合液(荧光标记的anti-mouse lgG/FITC通道和荧光标记的anti-rabbit
lgG
Cy5通道)加在TR凝胶表面。从载玻片上移除含一抗的TR凝胶并丢弃,将表面含二抗的TR凝胶加盖到含有细胞/组织的载玻片上,室温或37°C孵育,5min(细胞片)或20min(组织切片)。
3
使用含DAPI 封片液染色细胞核(~5min):封片使用封片液和24x50mm的盖玻片。
4
图像采集(~15min):全切片、三通道荧光扫描(FITC 488 /Cy5/DAPI)
5
去盖玻片(~5min):在5片标准Coplin罐中用TBS-Ts液或蒸馏水浸泡,去除盖玻片,每分开一张就转移到另外一个充满pH7.5的1xTris液(浓缩液10x=100mM
Tris.HCl, pH7.5 或TBS)的标准5片coplin罐中,去除蔗糖。
NB:这一步在有盖玻片的情况下重新定位载玻片时可能发生组织切片刮擦的。
6
抗体洗脱(用时~1h):预先在水浴锅内将抗体洗脱液加热到56°C(使用前加入2-ME)。将去盖玻片的切片放置到预热到标准5片coplin罐充满56°C的抗体洗脱液中,轻摇晃,
30min。然后在TBS-Ts洗涤液中洗涤3x5min每次更换新TBS-Ts液(或使用ddH₂O洗涤3x5min后使用TBS-Ts洗涤1x5min)
NB:抗体洗脱液有味道,在通风橱内进行。
7
下一轮一抗/二抗染色循环:染色前包被是选项,5% w/v
脱脂奶粉TBS-T溶液(或TBS-Ts溶液)1h包被
8
保存:如果中途停止试验,3天内不准备重新进行染色,将切片保存在-20°C
的切片保存液中,最好保存尚未洗脱抗体的切片,洗脱过程中能去除在保存过程中产生的自荧光和背景荧光。